TIGIT靶点的肿瘤免疫治疗研究进展
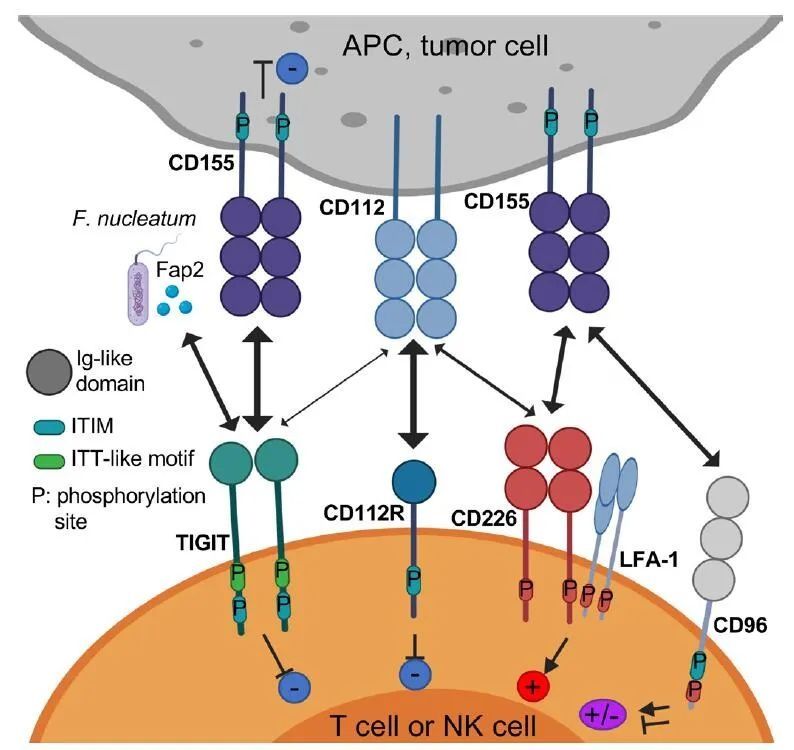
在过去的十几年中,T细胞免疫检查点的发现和抑制检查点的单克隆抗体的开发极大地改变了免疫治疗的结果。然而,PD-1的治疗仍然只有10-30%的患者表现出长期,持久的反应,大多数人群缺乏响应,还有获得性耐药以及免疫相关不良事件 (IRAE) 也是巨大的障碍。克服PD-1治疗局限性的机制之一是针对与肿瘤微环境相关的其他免疫检查点。 目前,TIGIT被认为是最有前景和潜力的靶点之一,多种证据支持TIGIT在限制肿瘤的适应性免疫和固有免疫方面起着关键作用。近日,百济和君实的交易又使TIGIT再一次成为热点。接下来,我们一起回顾一下TIGIT在肿瘤免疫学中的作用以及目前基于TIGIT的肿瘤免疫治疗的研究进展。 TIGIT功能轴与配体 TIGIT(也称为WUCAM、Vstm3、VSIG9)是Ig超家族的一种受体,在限制适应性和固有免疫方面起着关键作用。TIGIT参与了一个复杂的调控网络,涉及多个IRs(例如,CD96/TACTILE,CD112R/PVRIG)、一个竞争性共刺激受体(DNAM-1/CD226)和多个配体(例如,CD155,CD112)。因此,与CD28/CTLA-4/CD80/CD86通路有一些相似之处,抑制性受体和共刺激受体竞争性地与同一配体结合。 TIGIT由活化的CD8+T和CD4+T细胞、自然杀伤(NK)细胞、调节性T细胞(Tregs)和滤泡辅助性T细胞表达。与DNAM-1/CD226形成鲜明对比,TIGIT在原始T细胞弱表达。在癌症中,TIGIT与PD-1在小鼠和人类肿瘤抗原特异性CD8+T细胞和CD8+肿瘤浸润淋巴细胞(TIL)上共表达。它还与其他IRs共表达,如在肿瘤中耗竭的CD8+T细胞上的TIM-3和LAG-3。此外,TIGIT在健康人和癌症患者的外周血单核细胞中高表达,并在TME中进一步上调。 TIGIT结合两个配体,CD155和CD112,在单核细胞、树突状细胞(DC)和许多非造血细胞(包括不同组织学类型的肿瘤细胞)上表达。TIGIT结合CD155的亲和力高于竞争受体CD226和CD96。
TIGIT与CD112弱结合,CD112R结合CD112的亲和力高于CD226。有趣的是,CD155的表达在活性氧依赖的DNA损伤反应激活时增加,该反应调节NK细胞与T细胞和骨髓源性抑制细胞(MDSCs)的相互作用。此外,Fap2蛋白来自核梭杆菌(Fusobacterium nucleatum)是一种与结直肠癌相关的厌氧革兰氏共生菌,可直接与TIGIT结合,但不能与CD226结合,从而抑制NK细胞和T细胞介导的肿瘤反应。这些发现表明,肠道微生物组以TIGIT介导的方式调节固有免疫反应。
TIGIT结构与信号通路
TIGIT由一个细胞外免疫球蛋白(Ig)可变结构域、1型跨膜结构域和一个胞内结构域组成,胞内结构域其具有两个在小鼠和人类中保守的抑制基序:免疫受体基于酪氨酸的抑制基序(ITIM)和Ig尾酪氨酸样(ITT)基序。结合到CD155的TIGIT晶体结构显示两个TIGIT/CD155二聚体形成一个以TIGIT/TIGIT顺式同源二聚体为核心的异四聚体,每个TIGIT分子与一个CD155分子结合。这种顺反式受体聚集介导细胞粘附和信号传递。

在小鼠中,ITIM(Y227)或ITT样基序残基(Y233)的磷酸化可触发TIGIT抑制信号。然而,在人NK细胞系YTS中,TIGIT/CD155结合通过一个ITT样基序启动主要的抑制信号,而ITIM基序介导一个较小的抑制信号。在TIGIT/CD155结合激活后,ITT样基序在Tyr225处磷酸化,并与胞浆内信号分子Grb2和β-arrestin 2结合以招募含有肌醇的SH2磷酸酶-1(SHIP-1)。SHIP-1阻碍磷酸肌醇3激酶和丝裂原活化蛋白激酶信号传导。SHIP-1还抑制TRAF6和NF-κB的激活,导致NK细胞产生IFN-γ减少。
TIGIT的作用机制
TIGIT通过多种机制潜在地抑制固有和适应性免疫。 首先,在小鼠模型中,TIGIT通过与DCs上的CD155结合间接地阻碍T细胞的功能。 TIGIT与DCs的结合诱导CD155磷酸化并触发一个信号级联反应,促进形成免疫耐受性DCs,降低IL-12的产生并导致IL-10的增加。 第二,TIGIT直接表现出免疫细胞的内在抑制作用。 在小鼠和人类中,TIGIT抑制NK细胞脱颗粒、细胞因子生成和NK细胞介导的CD155+肿瘤细胞的细胞毒性。 TIGIT+NK细胞与表达CD155的MDSCs相互作用降低了ZAP70/Syk和ERK1/2的磷酸化,降低了NK细胞的细胞溶解能力。 第三,多项证据表明TIGIT阻碍CD155介导的CD226活化。 CD226是一种共刺激受体,广泛表达于免疫细胞,包括T细胞、NK细胞、单核细胞等,以及血小板。 TIGIT以比CD226更高的亲和力结合CD155,从而限制CD226介导的激活。 另外,TIGIT还直接在细胞上顺式结合CD226,破坏其与CD155的同源二聚体的结合能力。 第四,TIGIT/CD226表达的平衡调节T细胞和NK细胞的效应功能。 在TCR激活的CD4+T细胞中,用shRNA敲除TIGIT的表达增加了T-bet的表达和IFN-γ的产生; 相反,CD226基因敲除可降低T-bet表达和IFN-γ的产生。 可以通过平衡CD8+T细胞中的CD226和TIGIT来增强T细胞介导的肿瘤排斥反应。 第五,TIGIT作用于Tregs,增强免疫抑制功能和稳定性。 与TIGIT?Tregs相比,TIGIT+Tregs在外周和肿瘤部位上调了许多Treg基因标志物,包括Foxp3、Helios、neuronilin-1、CTLA-4、PD-1和LAG-3。 TIGIT+Tregs还抑制Th1和Th17的促炎性反应,但不抑制Th2。 TIGIT激活后,TIGIT++Tregs产生IL-10和纤维蛋白原样蛋白2,介导T细胞抑制。
文章来源:《中国肿瘤生物治疗杂志》 网址: http://www.zgzlswzlzz.cn/zonghexinwen/2022/0131/758.html