化工学院在肿瘤声动力治疗方面取得重要进展
由于超声波能够穿透人体,适于治疗周身蔓延的恶性肿瘤,声动力疗法(Sonodynamic Therapy,SDT)近年来颇受关注。SDT是低强度超声和声敏化药剂结合、治疗癌变细胞或组织的新型无创伤疗法,其有效性和可行性不仅取决于SDT仪器的研制,还与分子的生物导向性、有效性和低毒副作用的声敏感分子的发现密切相关,然而现今尚未有成型的标准供研究者使用。
近日,由化工学院药学系赵伟杰教授领衔的研究团队在超声动力抗恶性肿瘤研究上取得重要进展。团队在细胞小动物试验仪器研制、超声动力应答分子设计合成、肿瘤细胞活性抑制、动物体内组织分布、原位肿瘤及转移病灶抗肿瘤评价和免疫治疗等方面进行了研究与分析,发现设计合成的新化合物在声动力驱动下,能够发挥分子机器作用治疗恶性肿瘤,提高抗肿瘤免疫。
10月21日,相关研究成果以An Ultrasound-Driven Immune Boosting Molecular Machine for Systemic Tumor Suppression为题在线发表于Science子刊Science Advances,药学系李广哲副教授、精细化工国家重点实验室邵堃教授、赵伟杰教授为论文共同通讯作者,博士研究生王柳为论文第一作者,我校为唯一通讯单位。
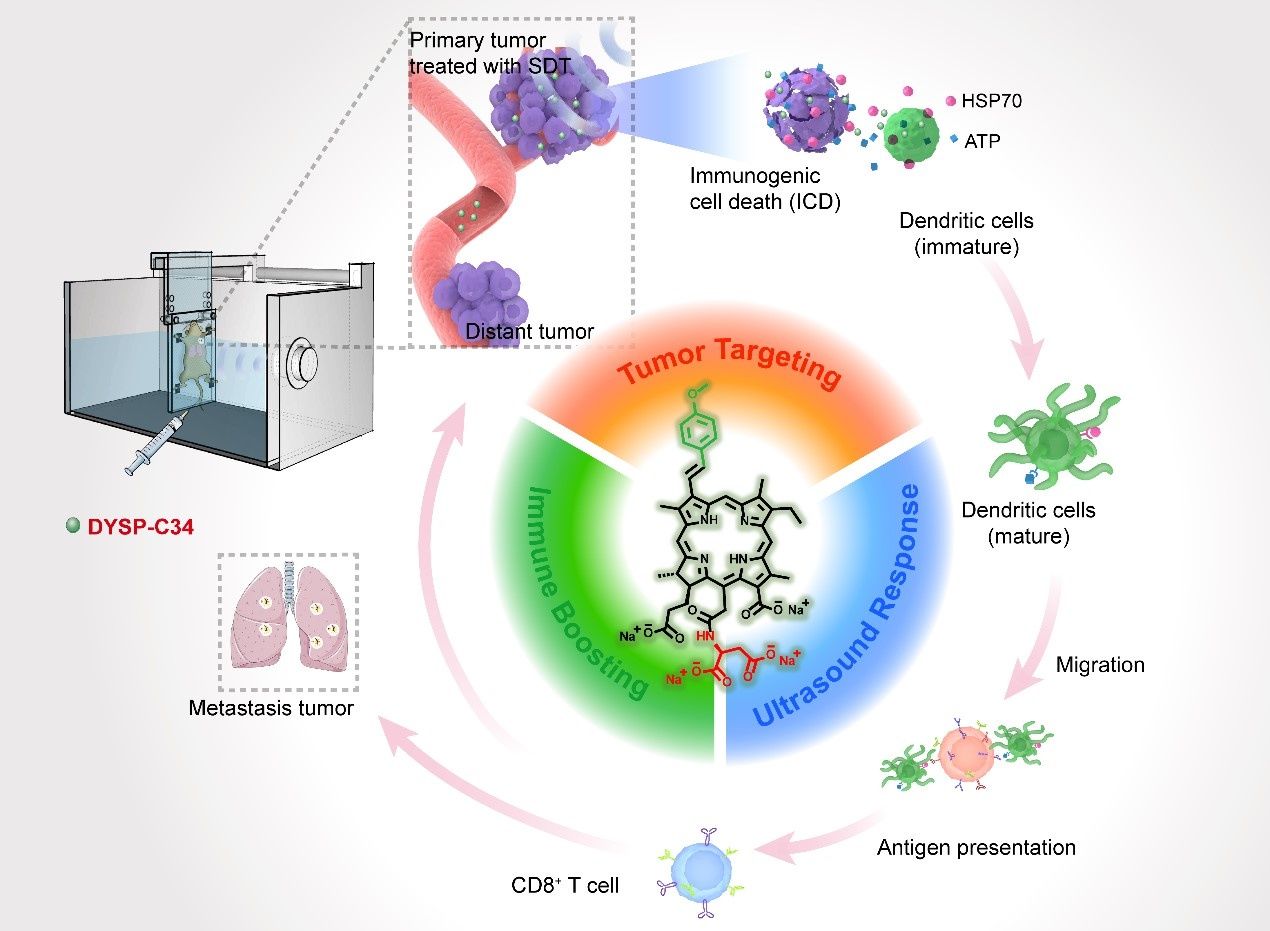
图1.超声驱动的分子机器DYSP-C34用于周身肿瘤抑制。图片来源:Sci. Adv.
研究团队以天然微藻中制取的二氢卟吩(CHC)为基础分子骨架,设计合成系列新型超声应答分子。通过将32-芳基和15-天冬氨酰基引入CHC,发现了超声驱动的多功能“分子机器”(小分子化合物DYSP-C34)。实验证实这种战略性的化学修饰成功赋予了DYSP-C34多种有利特性,包括优秀的肿瘤部位蓄积能力、有效的超声触发细胞毒效应和内在的免疫增强能力,毒副作用甚微。在超声波驱动下,DYSP-C34不仅可以作为肿瘤细胞杀伤剂,还可以作为免疫增强剂,通过直接刺激树突状细胞呈现强大的适应性抗肿瘤免疫,对原发性实体瘤进行治疗并抑制转移。经多个原位癌伴随转移灶的动物模型试验,DYSP-C34介导的SDT能够有效发挥周身的肿瘤抑制效果,实现了由单一分子介导的声动力-免疫联合治疗。
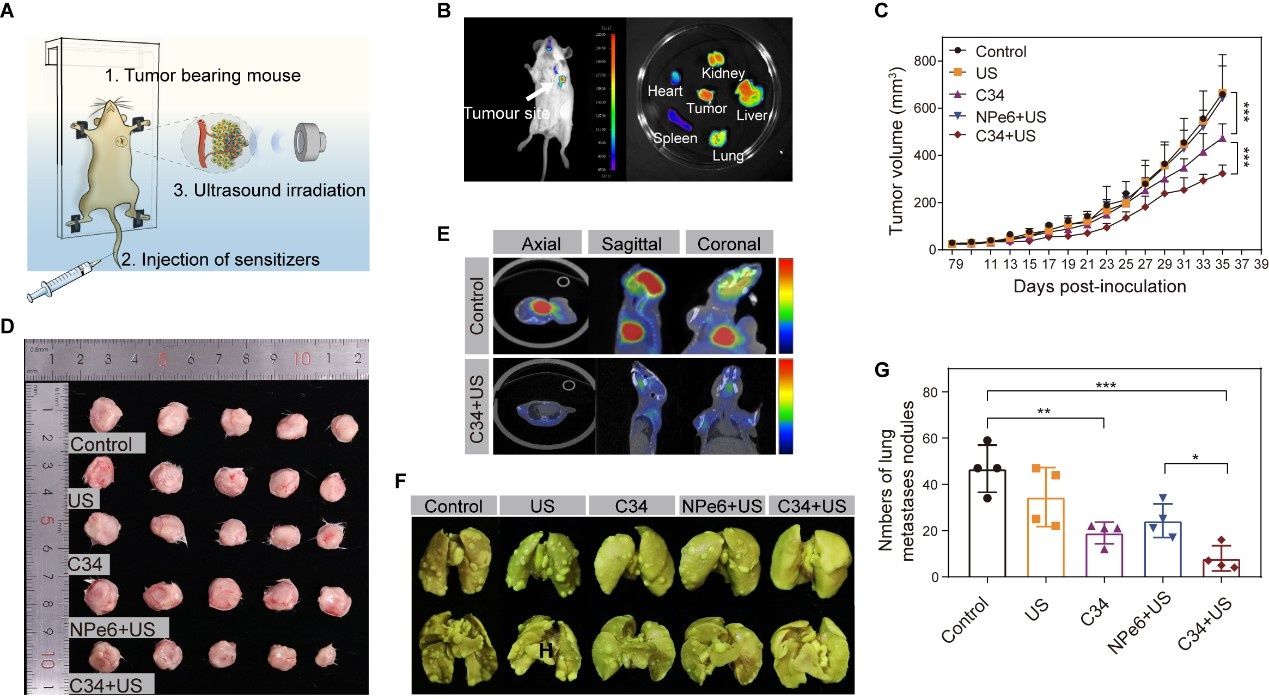
图2. C34介导的SDT对原发性肿瘤生长和肺转移的协同抑制作用。图片来源:Sci. Adv.
DYSP-C34“分子机器”介导的声动力-免疫联合疗法可广泛地应用于不同类型的原发实体肿瘤,为临床提供了简便的治疗选择,展现出很高的临床转化价值和实际应用前景。
目前,此项科学研究工作正在深入进行中,相关科学成果将及时报道。
文章来源:《中国肿瘤生物治疗杂志》 网址: http://www.zgzlswzlzz.cn/zonghexinwen/2021/1028/708.html