深圳大学黄鹏教授团队基于纳米催化实现肿瘤治
近日,深圳大学黄鹏特聘教授团队在国际顶级学术期刊《Advanced Materials》(影响因子27.398,中科院JCR 1区,TOP期刊)上发表了题为《Nanocatalytic Theranostics with Glutathione Depletion and Enhanced Reactive Oxygen Species Generation for Efficient Cancer Therapy》的文章。这篇文章的所有工作均在深圳大学完成,该团队付连花副研究员、万艺林硕士研究生和漆超博士后为共同第一作者,黄鹏教授为通讯作者,深圳大学为唯一单位和唯一通信单位,该团队所在的生物医学工程学科属于广东省优势重点学科。
 化学动力疗法(CDT)是近几年发展起来的一种无创的癌症治疗方法,主要利用金属离子如Fe2+、Mn2+、Cu+等与肿瘤内过表达的过氧化氢(H2O2)发生芬顿或类芬顿反应,将其转化为毒性更强的羟基自由基(?OH),从而高效地杀死肿瘤细胞。然而,由于内源性H2O2含量有限,CDT的效果往往不如人意。而肿瘤细胞内高浓度的抗氧化成分如谷胱甘肽(GSH)又会清除产生的活性氧,从而降低CDT疗效。基于此,本研究开发了一种具有产生H2O2及清除GSH功能的纳米催化诊疗剂(PGC-DOX),用于实现肿瘤饥饿/CDT/化疗协同治疗(如图)。
化学动力疗法(CDT)是近几年发展起来的一种无创的癌症治疗方法,主要利用金属离子如Fe2+、Mn2+、Cu+等与肿瘤内过表达的过氧化氢(H2O2)发生芬顿或类芬顿反应,将其转化为毒性更强的羟基自由基(?OH),从而高效地杀死肿瘤细胞。然而,由于内源性H2O2含量有限,CDT的效果往往不如人意。而肿瘤细胞内高浓度的抗氧化成分如谷胱甘肽(GSH)又会清除产生的活性氧,从而降低CDT疗效。基于此,本研究开发了一种具有产生H2O2及清除GSH功能的纳米催化诊疗剂(PGC-DOX),用于实现肿瘤饥饿/CDT/化疗协同治疗(如图)。
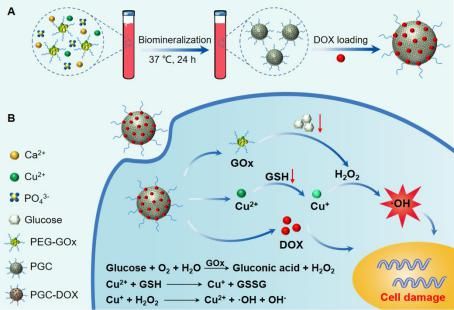 首先以聚乙二醇修饰的葡萄糖氧化酶(GOx)为模板,采用仿生矿化的方法制备铜离子掺杂的磷酸钙纳米颗粒,然后装载抗癌药阿霉素(DOX),最终获得PGC-DOX。利用磷酸钙的pH响应降解特性,PGC-DOX在肿瘤微酸性条件下降解释放出GOx、Cu2+及DOX。GOx催化肿瘤内葡萄糖降解产生H2O2,不仅可以通过消耗肿瘤营养物实现饥饿治疗,产生的H2O2还可用于后续的类芬顿反应。同时,Cu2+与GSH之间的氧化还原反应不仅可以清除GSH提高肿瘤细胞的氧化应激,还原产物Cu+还可通过类芬顿反应将H2O2转化成毒性更强的?OH,增强CDT疗效。此外,该纳米催化诊疗剂所有组分均可降解,具有较高的生物安全性,具有潜在的临床转应用价值。
首先以聚乙二醇修饰的葡萄糖氧化酶(GOx)为模板,采用仿生矿化的方法制备铜离子掺杂的磷酸钙纳米颗粒,然后装载抗癌药阿霉素(DOX),最终获得PGC-DOX。利用磷酸钙的pH响应降解特性,PGC-DOX在肿瘤微酸性条件下降解释放出GOx、Cu2+及DOX。GOx催化肿瘤内葡萄糖降解产生H2O2,不仅可以通过消耗肿瘤营养物实现饥饿治疗,产生的H2O2还可用于后续的类芬顿反应。同时,Cu2+与GSH之间的氧化还原反应不仅可以清除GSH提高肿瘤细胞的氧化应激,还原产物Cu+还可通过类芬顿反应将H2O2转化成毒性更强的?OH,增强CDT疗效。此外,该纳米催化诊疗剂所有组分均可降解,具有较高的生物安全性,具有潜在的临床转应用价值。
本研究工作得到了国家重点研发计划,国家自然科学基金,广东省自然科学基金、深圳市科创委等项目的支持。
来源:深圳大学
https://onlinelibrary.wiley.com/doi/10.1002/adma.202006892
文章来源:《中国肿瘤生物治疗杂志》 网址: http://www.zgzlswzlzz.cn/zonghexinwen/2021/0210/482.html